近年來,隨著科學技術的不斷發展,印制電路板行業取得了長足的進展,在印制電路板生產過程中會產生含磷廢水,此類廢水主要產生于化學鍍鎳工藝,含磷廢水中存在的磷對生態環境的危害較大,尤其是近年來經常發生的水體富營養化,已經引起了人們的廣泛關注。
含磷廢水中磷主要以次磷酸鹽、亞磷酸鹽的形式存在,廢水中還含有絡合物、穩定劑和光亮劑,如:檸檬酸、酒石酸、蘋果酸、羥基乙酸、丁二酸、琥珀酸、醋酸等等。次、亞磷酸鹽與廢水中的有機物反應生成更復雜的物質,包含無機鹽、絡合物、有機物等,使得廢水很難降解。目前,對于印制電路板含磷廢水的處理方法主要有化學沉淀法、離子交換法、生物處理法、膜分離法及芬頓氧化法等。現介紹這些處理工藝及其優缺點,并根據我們公司實際情況,確定采用芬頓氧化處理含磷廢水的工藝,以下介紹芬頓氧化法處理含磷廢水的工藝。
1、含磷廢水的處理工藝比較
1.1 化學沉淀法
化學沉淀法是在廢水中加入沉淀劑(主要為鈣鹽、鐵鹽等),在一定的pH值條件下,沉淀劑與廢水中的含磷污染物進行反應形成不溶沉淀物去除。
美國Parker發現,使用石灰乳處理,產生的沉淀體積雖然較大,但處理效果優于采用苛性鈉的處理方法。
西北工業大學的王利采用乙酸鈣為沉淀劑去除亞磷酸根,反應溫度40~50℃,乙酸鈣的投加量為90~100g/L。具體反應方程式如下:

化學沉淀法的優點是工藝比較成熟、實用,操作費用低,但化學沉淀法僅能去除廢水中的正磷酸根和亞磷酸根,不能去除水中的次磷酸根,況且石灰乳反應產生大量廢渣,必需妥善處理,否則造成二次污染。
1.2 離子交換法
離子交換法主要是采用陰離子交換樹脂吸附廢水中的次、亞磷酸鹽等陰離子物質。1955年Spoulding首次發表專利,用陰離子交換樹脂處理含磷廢水,可以將廢液中的亞磷酸鹽的質量濃度從110.8g/L降至50.4g/L。
離子交換法可很好的去除廢水中的含磷污染物,但廢水中的其他陰離子同樣被吸附去除,導致樹脂很快飽和,需要重新再生才能繼續使用,再生需要消耗大量堿液,與此同時離子交換樹脂一次性投資較大,設備較復雜。此法需要耗費較高成本,不適宜大規模推廣。
1.3 生物處理法
1.3.1 生物除磷原理
生物除磷,是利用聚磷菌一類的微生物,能夠過量地、在數量上超過其生理需要地從外部環境中攝取磷,并將磷以聚合的形式儲藏在菌體內,形成高磷污泥,排出系統外,達到從廢水中除磷的效果。基本過程如下:
(1)聚磷菌對磷的過量攝取。
在好氧條件下,聚磷菌進行有氧呼吸,不斷氧化分解體內儲存的有機物,同時也不斷從外部環境中攝取有機物,由于氧化分解不斷放出能量,能量為ADP((二磷酸腺苷))所獲得,并結合H3PO4合成ATP(三磷酸腺苷)。即式(4)。
![]()
(2)聚磷菌的放磷。在厭氧條件下,聚磷菌體內的ATP進行水解,放出H3PO4和能量,形成ADP,即式(5)。
![]()
1.3.2 生物除磷工藝
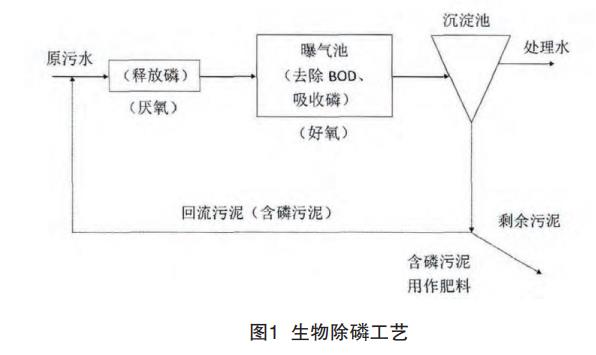
生物除磷工藝一般采用厭氧-好氧活性污泥法,該工藝同時具有去除有機物和除磷的功能。具體做法是在常規的好氧活性污泥法處理系統前增加一段厭氧生物處理過程,經過預處理的廢水與回流污泥(含磷污泥)一起進入厭氧段,然后在進入好氧段。回流污泥在厭氧段吸收一部分有機物并釋放出大量磷,進入好氧段后,廢水中的有機物得到好氧降解,同時污泥將大量攝取廢水中的磷,部分富磷污泥以剩余污泥的形式排出,實現磷的去除。具體工藝流程如圖1所示。此法流程簡單,不需投加化學藥品,運行費用較低,但場地占地面積大,一次性投資較大,并且除磷效率較低,一般處理城市污水時的除磷效率只有75%左右,我司華僑城廠活性污泥法除磷效率只有20%左右,主要由于廢水中含磷濃度較低,在5mg/l以下,且廢水生化時間短導致處理效率較低。
1.4 膜分離法
膜分離法的主要原理是,在一定的壓力下,當原液流過膜表面時,膜表面密布的許多細小的微孔只允許水及小分子物質通過而成為透過液,而原液中體積大于膜表面微孔徑的物質則被截留在膜的進液側,成為濃縮液,因而實現對原液的分離和濃縮的目的。膜分離法因其分離高效、無二次污染、設備占地面積小而得到廣泛應用。一般主要使用的設備是反滲透膜。反滲透膜能截留大于0.0001微米的物質,是最精細的一種膜分離產品,其能有效截留所有溶解鹽分及分子量大于100的有機物,膜分離法產生的純水可以回收繼續使用。
膜分離法主要缺點是反滲透膜一次性投資較貴,且處理廢水時需要結合前處理使用,否則膜易堵塞,堵塞后需要化學清洗才能繼續使用,并且化學清洗多次后膜的處理效率降低甚至喪失選擇透過性而不能繼續使用。
1.5 芬頓氧化法
1.5.1 芬頓氧化法介紹
Fenton(芬頓)氧化法是為數不多的以人名命名的無機化學反應之一。1893年,化學家FentonHJ發現,過氧化氫(H2O2)與二價鐵離子的混合溶液具有強氧化性,可以將當時很多已知的有機化合物如羧酸、醇、酯類氧化為無機態,氧化效果十分顯著。但此后半個多世紀中,這種氧化性試劑卻因為氧化性極強沒有被太多重視。但進入20世紀70年代,芬頓試劑在環境化學中找到了它的位置,具有去除難降解有機污染物的高能力的芬頓試劑,在印染廢水、含油廢水、含酚廢水、焦化廢水、含硝基苯廢水、二苯胺廢水等廢水處理中體現了很廣泛的應用。當芬頓發現芬頓試劑時,尚不清楚過氧化氫與二價鐵離子反應到底生成了什么氧化劑具有如此強的氧化能力。二十多年后,有人假設可能反應中產生了羥基自由基,否則,氧化性不會有如此強。因此,以后人們采用了一個較廣泛引用的化學反應方程式來描述芬頓試劑中發生的化學反應見式(6)。
![]()
從上式可以看出,1mol的H2O2與1mol的Fe2+反應后生成1mol的Fe3+,同時伴隨生成1mol的OH外加1mol的羥基自由基。正是羥基自由基的存在,使得芬頓試劑具有強的氧化能力。據計算在pH=4的溶液中,·OH自由基的氧化電勢高達2.73V。在自然界中,氧化能力在溶液中僅次于氟氣。因此,持久性有機物,特別是通常的試劑難以氧化的芳香類化合物及一些雜環類化合物,在芬頓試劑面前全部被無選擇氧化降解掉。
1.5.2 芬頓氧化除磷工藝
本工藝借鑒芬頓氧化在其他廢水處理中的應用,采用芬頓氧化的方式,將廢水中的次、亞磷酸根氧化為正磷酸根,在反應過程中,Fe2+被氧化為Fe3+,Fe33+與正磷酸根反應生產磷酸鐵沉淀,從而將廢水中的磷去除,反應方程式如式(7)~式(9):
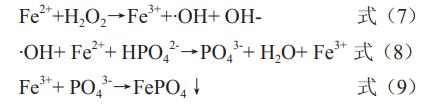
芬頓氧化工藝能很好的將印制電路板含磷廢水中的次、亞磷酸根氧化為正磷酸根,在pH值大于8時形成磷酸鐵沉淀,進而達到除磷的目的,對于深南電路華僑城廠的含磷廢水,此法磷的去除率可達95%以上。
深南電路華僑城廠含磷廢水產生量較少,約15噸/天,根據現場的實際情況,綜合比較,芬頓氧化法為最佳處理工藝。
2、芬頓氧化處理含磷廢水試驗
2.1 儀器與試劑
攪拌機、pH儀表、總磷測定儀器與試劑、20%硫酸亞鐵溶液、27.5%雙氧水。
2.2 廢水水質
廢水取自化金生產線的鍍鎳后的水洗槽廢水,水質見表1。

2.3 實驗方法
取100L廢水,將pH調節到3~4之間,加入一定量的硫酸亞鐵和雙氧水溶液,攪拌反應一段時間后,調節pH至8~9之間,加入絮凝劑進行絮凝沉淀,取上清液測定總磷。
2.4 結果與討論
2.4.1 硫酸亞鐵與雙氧水配比對總磷去除效果的影響分析
(1)加入20%硫酸亞鐵10L,分別加入雙氧水0.5L、0.75L、1L、1.25L、1.5L進行試驗,測定總磷去除效果,結果如圖2所示。
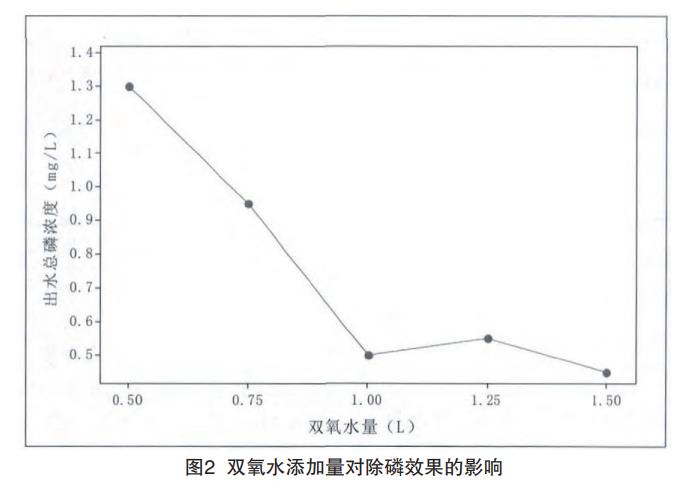
從圖2可見,隨著雙氧水加入量的不斷增大,出水總磷濃度不斷降低,雙氧水加入1L時,總磷去除效果最好,繼續增大加入量,出水總磷濃度變化不明顯。綜合考慮,雙氧水加入量為1L。
(2)加入1L雙氧水,分別加入20%硫酸亞鐵溶液1L至10L進行試驗,測定總磷去除效果,結果見圖3。
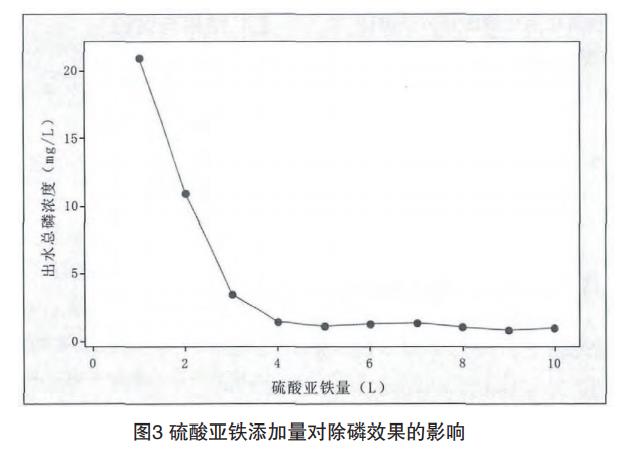
從圖3可見,隨著硫酸亞鐵加入量的不斷增大,出水總磷濃度不斷降低,當硫酸亞鐵加入量繼續增大時,出水總磷濃度變化不明顯。綜合考慮,硫酸亞鐵加入量為4L。
從以上兩個結果分析,硫酸亞鐵和雙氧水加入體積比為4:1時,總磷去除效果最好。
2.4.2 反應時間對廢水處理效果的影響分析
在100L廢水中加入硫酸亞鐵4L,雙氧水1L,分別在反應0.5h至3h的情況下,分析上清液總磷濃度,結果如圖4。
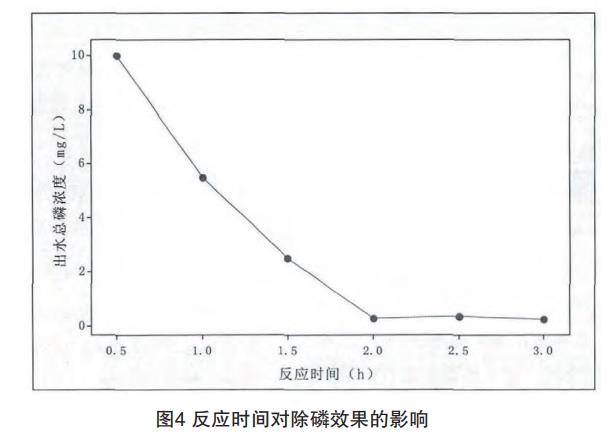
從圖4可見,隨著反應時間不斷延長,出水總磷濃度不斷降低,當反應時間2小時后繼續延長時,出水總磷濃度變化不明顯。綜合考慮,反應時間取2h。
2.4.3 沉淀pH值對廢水處理效果的影響分析
反應完畢后,分別調節pH值至7.0、7.5、8.0、8.5、9.0、9.5、10.0,測定上清液總磷濃度,結果如圖5所示。
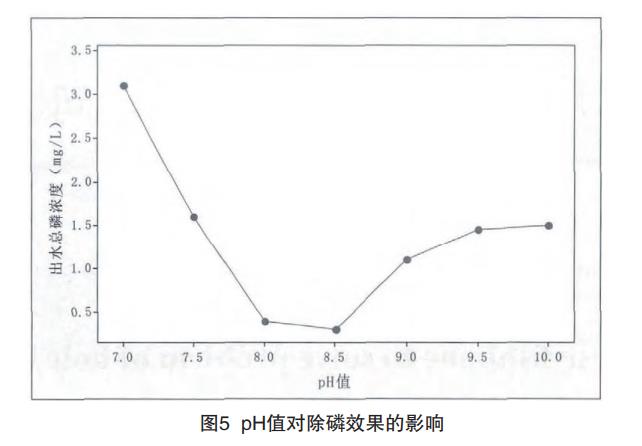
從圖5可見,當pH<8.5時,隨著pH增大,出水 總磷濃度不斷降低;當pH>8.5時,隨著pH增大,出水總磷濃度不斷升高。綜合考慮,沉淀pH值取8~8.5之間。
2.5 試驗結論
芬頓氧化法處理含磷廢水,硫酸亞鐵和雙氧水加入體積比4:1,加入量為每立方廢水加入20%硫酸亞鐵溶液40L,27.5%雙氧水10L,反應時間2h,反應完畢后調節pH至8~8.5,加入絮凝劑進行絮凝沉淀,此時出水總磷濃度最低,處理效果最好。
3、結語
印制電路板含磷廢水成分復雜,不能通過簡單的化學沉淀法去除,必須經過特殊處理后,將廢水中的次、亞磷酸鹽轉化為正磷酸鹽后,才能通過加入沉淀劑的方式將其去除。
除磷的方法很多,不同規模、不同需求的廢水需要根據實際情況確定處理工藝。對于深南電路含磷廢水,產生量約10~15噸/天,排放值通常低于0.310×10-6。經過比較,采用芬頓氧化后沉淀的方法處理最佳。
隨著對廢水處理要求的不斷提高,需要繼續研究含磷廢水的處理工藝,找到處理效果更佳成本更低的工藝方法是今后努力的方向。

 18853672655
18853672655

